AOD en pédiatrie : Etude EINSTEIN JR Phase III
DR MAHFOUDHI Houaida
L’incidence de la maladie thromboembolique veineuse (MTEV) chez l’enfant est 20 à 100 fois moindre que chez l’adulte. Chez l’enfant, la physiopathologie de la thrombose, sa localisation anatomique et ses réponses pharmacologiques aux traitements anticoagulants diffèrent des adultes.
Les Essais randomisés pour évaluer le traitement anticoagulant pour les MTEV ont presque exclusivement ciblé l'adulte avec un seul petit essai randomisé chez les enfants rapporté en 2003.
L’objectif de l’étude EINSTEIN JR Phase III était de comparer l’efficacité et l’innocuité des schémas posologiques pédiatriques de Rivaroxaban ajustés au poids corporel avec ceux des anticoagulants standards chez les enfants atteints de MTEV aigüe ayant reçu au moins 5 jours de traitement par héparine.
Méthodologie
Dans cette étude multicentrique, à groupes parallèles, ouverte et randomisée, des enfants (âgés de 0 à 17 ans), fréquentant 107 hôpitaux pédiatriques dans 28 pays avec une MTEV aiguë documentée et ayant commencé une héparinothérapie, ont été randomisés pour recevoir des anticoagulants standards (poursuite de l’héparine ou passage à un antivitamine K) ou du Rivaroxaban. Les enfants alloués au Rivaroxaban (administré sous forme de comprimés ou en suspension) ont reçu une dose équivalente à 20 mg pour l’adulte ajustée au poids corporel, administrée une fois par jour (pour des poids corporels ≥ 30 kg), deux fois par jour (pour des poids corporels de 12 à < 30 kg) ou trois fois par jour (pour des poids corporels < 12 kg).
La randomisation a été stratifiée selon l'âge et le siège de la thromboembolie veineuse (TEV).
La période de traitement principale était de 3 mois (1 mois chez les enfants de < 2 ans atteints de TEV liée au cathéter).
Le principal critère d'évaluation de l'efficacité était la TEV symptomatique récurrente et le principal critère d'évaluation de l'innocuité était la combinaison de saignements sévères et de saignements non sévères cliniquement significatifs.
Ces 2 critères ont été évalués de manière centralisée par des investigateurs qui n'étaient pas au courant de l'attribution du traitement.
Le critère secondaire d’efficacité était la résolution du thrombus à l'imagerie répétée obtenue à la fin de la période du traitement et comparée aux tests d'imagerie de base.
EINSTEIN6Jr. Phase III Study Design
Résultats :
De novembre 2014 à septembre 2018, 500 (96 %) des 520 enfants dépistés pour l'éligibilité ont été inscrits. 25% avaient des thromboses en lien avec un cathéter et 51 % des thromboses n’étaient pas liés à un cathéter .
23 % des thromboses étaient localisées au niveau des veines et sinus cérébraux, 33 % dans les membres inférieurs, 12 % dans les membres supérieurs et 10 % dans les veines jugulaires. Il y avait 16 % d’embolies pulmonaires.
Les thromboses veineuses étaient non provoquées dans 11% des cas. Les thromboses étaient provoquées par un facteur de risque persistant dans 17% des cas et un facteur de risque transitoire dans 47% des cas.
Après un suivi médian de 91 jours (IQR 87-95), chez les enfants ayant eu une période de traitement à l'étude de 3 mois (n = 463), et de 31 jours (IQR 29-35), chez les enfants ayant eu une période de traitement à l'étude de 1 mois (n = 37), Les résultats ont montré que l'étude atteignait tous les paramètres prédéfinis:
1)une TEV récurrente symptomatique est survenue chez quatre (1 %) des 335 enfants recevant du Rivaroxaban et cinq (3 %) des 165 enfants recevant des anticoagulants standards (risque relatif [HR] 0·40, IC à 95 % 0·11 -1·41).
2)Des saignements majeurs ou non majeurs cliniquement significatifs chez les participants ayant reçu ≥ 1 dose sont survenus chez dix (3 %) des 329 enfants (tous non majeurs) recevant du Rivaroxaban et chez trois (2 %) des 162 enfants (deux majeurs et un non majeur) recevant des anticoagulants standards (HR 1·58, IC 95 % 0·51-6·27).
3)En termes de critère composite (bénéfice clinique net) de la TEV récidivante et des saignements majeurs, l'incidence dans le groupe de traitement par Rivaroxaban était de 1,2% et l'incidence dans le groupe anticoagulant standard était de 4,2% (HR=0,30, 95% CI: 0,08 à 0,93).
(4) Une imagerie répétée à la fin de la période de traitement a montré que le Rivaroxaban était meilleur que le traitement anticoagulant standard pour améliorer la charge thrombotique (p=0,012).
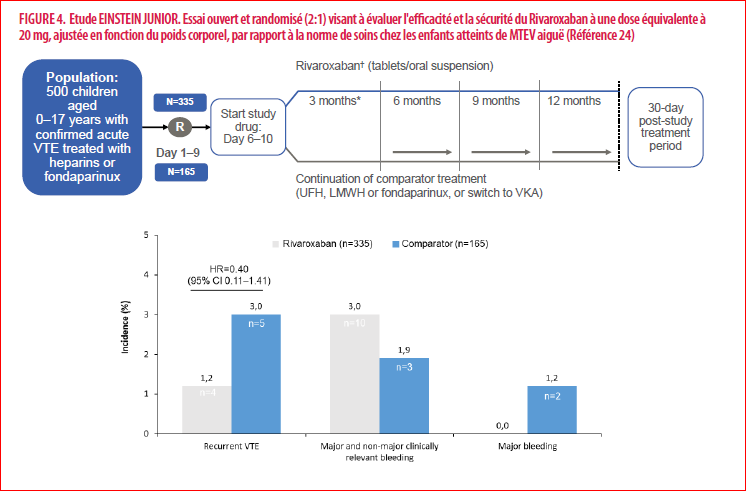
Les estimations absolues et relatives de l'efficacité et de l'innocuité du Rivaroxaban par rapport aux estimations standard de l'anticoagulation étaient similaires à celles des études sur le Rivaroxaban chez l'adulte. Il n'y a eu aucun décès lié au traitement.
Conclusion
Chez les enfants atteints de TEV aiguë, le traitement par le Rivaroxaban a entraîné un risque de récidive également faible et une charge thrombotique réduite sans augmentation des saignements, par rapport aux anticoagulants standards.
Sur la base de cette analyse, les chercheurs concluent que les régimes pédiatriques de rivaroxaban ajustés au poids corporel avec des comprimés ou une suspension sont validés et offrent une nouvelle option de traitement alternative pour la TEV chez les enfants.
Référence :
Male C, Lensing AWA, Palumbo JS, et al. Rivaroxaban compared with standard anticoagulants for the treatment of acute venous thromboembolism in children: a randomised, controlled, phase 3 trial. Lancet Haematol. 2020;7(1):e18-e27.
doi:10.1016/S2352-3026(19)30219-4
https://pubmed.ncbi.nlm.nih.gov/31699660/
